کتاب اصول علم و مهندسی توسط قلم توانای استاد سید حسین تویسرکانی به تالیف درآمده. و در دسترس علاقه مندان قرار گرفته است. هر مبحث این کتاب شما را به دریچهای از دانش علم مواد میبرد. امروز بخشی از کتاب اصول علم مهنرسی و مواد با عنوان آرایش الکترونی اتم را با یکدیگر میخوانیم. در این بخش آرایش الکترونی اتم را بررسی میکنیم. مبحثی جذاب و بسیار زیبا را استیل پایدار به اشتراک میگذارد.
آرایش الکترونی اتم
آرایش الکترونی اتم
حرکت الکترون در اطراف هسته اتم پیچیده است و بر اساس تئوری مکانیک موجی یا مکانیک کوانتومی پایه گذاری شده. طبق فرضیه شرودینگر (Schrodinger) منطقهای از فضای اطراف هسته اتم که احتمال پیدا کردن الکترون در آن در حد ماکزیمم باشد مورد توجه قرار گرفت. به عبارت دیگر حرکت الکترونها را میتوان مشابه حرکت ابری در اطراف هسته اتم تصور کرد.
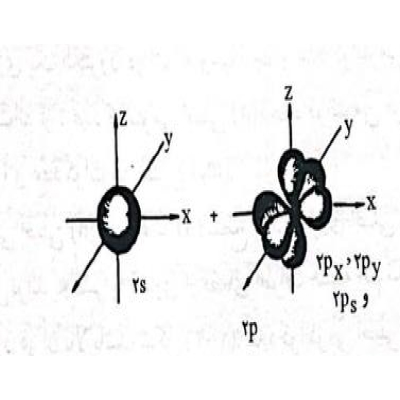
موقعیت این ابرهای الکترونی بعضی مواقع به شکل کروی و گاهی در جهات خاصی کشیده شده است. (هنگامیکه موقعیت ابر الکترونی به شکل کره باشد آن را اوربیتال یا مدار S و زمانی که در جهتی کشیده شده باشد اوربیتال یا مدار p و d را خواهیم داشت) بدین ترتیب محل دقیق یک الکترون را در یک زمان معین نمیتوان مشخص کرد ولی احتمال محل اقامت الکترون را میتوان در حجم کوچکی از فضا به صورت توزیع یک ابر متراکم نمایش داد.
حجمی از فضا که الکترون در حدود ۹۰٪ از وقت خود را در آنجا میگذراند و یا به عبارتی در هر لحظه از زمان احتمال یافتن ا لکترون در آن مکان ۹۰٪ است، اوربیتال نامیده میشود.
موقعیتهای اوربیتالهای S اندازه اوربیتالها با افزایش n بزرگتر میشود.

موقعیت اوربیتالهای p(Pz.Py.Px)
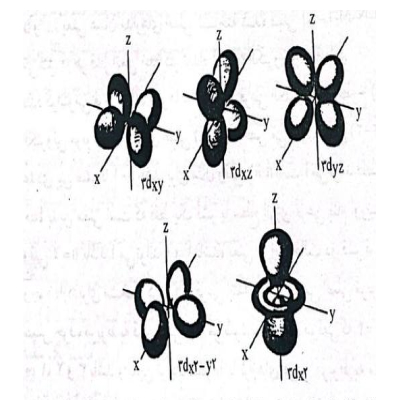
موقعیت اوربیتال های d
تعداد زیادی از خواص و رفتار اتمها را میتوان برحسب تعداد الکترونهای موجود در مدار خارجی و همچنین انرژی نسبی اوربیتالهای اشغال شده توسط این الکترونها توجیه کرد.
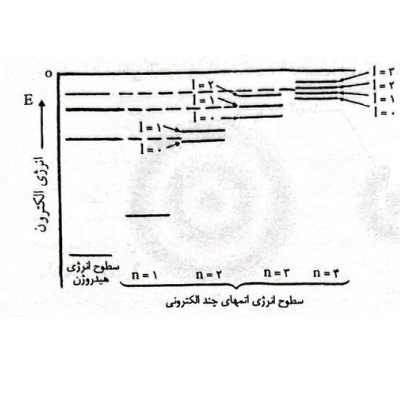
برخلاف موقعیت الکترون که نمیتوان آن را دقیقا مشخص کرد، مقدار انرژی الکترون را میتوان با اسپکترومتری تعیین کرد. شکل زیر سطوح انرژی اوربیتالهای مختلف را در مقایسه با یکدیگر نشان میدهد.
مقایسه بین ترازهای انرژی در هیدروژن و اتمهایی با بیش از یک الکترون
موقعیت انرژی یک الکترون در اتم به وسیله چهار عدد کوانتومی مشخص میشود. این چهار عدد عبارتاند از: عدد کوانتومی اصلی (n)، عدد کوانتومی فرعی (l)، عدد کوانتومی مغناطیسی (M1) و عدد کوانتومی اسپین (Ms).
۱. عدد کوانتومی اصلی
(n): این عدد (n) سطح یا تراز انرژی اصلی را برای الکترونهای مشخص میکند و میتواند به قشر یا مداری از فضای اطراف هسته اتم نسبت داده شود که احتمال یافتن الکترون در آن بالا باشد. شکلهای قبل عدد کوانتومی اصلی n عدد صحیح ۱،۲،۳،۴،۵ و … ، یعنی همان مدارهای اصلی شناخته شده قبلی (… O N M L K) را مشخص میکند. در هر قشر اتمی حداکثر تعداد الکترونها وجود دارد.

۲. عدد کوانتومی فرعی (l): قشرها یا مدارهای فرعی الکترونی یا سطوح (یا ترازهای) فرعی الکترونی مربوط به قشرهای اصلی (n) را مشخص میسازد. عدد ۱ میتواند عددی بین صفر تا n-1 باشد. برای مثال وقتی n=1 است ۱ میتواند فقط برابر صفر باشد و ۰=۱ بدین معنی است که فقط یک قشر یا سطح انرژی فرعی به نام اوربیتال s وجود دارد. وقتی n=2 باشد ۱ می تواند ۰ و یا ۱ باشد& یعنی در این حالت دو قشر فرعی به نام ۲s و ۲p وجود دارد. برای مشخص کردن لایه فرعی ابتدا عدد کوانتومی اصلی مربوط به مدار اصلی و سپس حرف مربوط به قشر فرعی ارائه میشود.
برای مثال موقعی که n=4 است، ۱ میتواند ۰،۱،۲ و ۳ باشد و بدین ترتیب قشرها یا ترازهای فرعی مربوط به مدار اصلی n=4 به ترتیب ۴s,4p,4d,4f خواهد بود. به طور کلی موقعیت الکترونها یا سطوح انرژی فرعی الکترونهای مربوط به مدار فرعی ۰=۱ به نام اوربیتال s و سطوح فرعی الکترونهای مربوط به I=1 به نام اوربیتال P و سطوح انرژی فرعی الکترونهای مربوط به I=2 به نام اوربیتال d و سطوح انرژی فرعی الکترونهای مربوط به I=3 به نام اوربیتالهای f است. شکل الف اوربیتالهای s که تا حدودی به صورت مدار کروی شکل متقارن در اطراف هسته اتم فرض شده است و شکل ب اوربیتالهای p را که مقداری در جهت محورهای کشیده شده است و شکل ج اوربیتالهای d را نشان میدهد. شکل اوربیتالهای f پیچیدهتر خواهد بود.

برای دسترسی بیشتر به منابع کتاب اصول علم مهندسی مواد فقط کافیست کلیک کنید و استیل پایدار را دنبال کنید.
۳. عدد کوانتومی مغناطیسی (∂M): این عدد جهت فضایی یک اوربیتال ساده اتمی را مشخص میکند و تاثیر کمی بر انرژی الکترون دارد. ∂M میتواند عدد صحیحی بین t- و t+ که شامل عدد صفر هم است، باشد. برای مثال موقعی که t=0 است مقدار مجاز برای ∂M صفر است و وقتی t=1 است، سه مقدار مجاز برای ∂M وجود دارد، یعنی ۱-، ۰ و ۱+. به طور کلی (۲t+1) مقدار مجاز برای ∂M وجود دارد. برحسب اوربیتال s,p,d و f حداکثر یک اوربیتال s و سه اوربیتال p، پنج اوربیتال d و هفت اوربیتال f برای هر سه سطح انرژی فرعی s,p,d,f وجود دارد.
۴. عدد کوانتومی اسپین (Ms): عدد کوانتومی اسپین یا اصل طرد پاولی دو جهت مجاز چرخش را برای هر الکترون حول محورش مشخص میکند. این دو جهت چرخش مخالف یکدیگر بوده و مقدار مجاز آن ۱/۲+ و ۱/۲- است. چرخش هر یک از الکترونها با بار الکتریکی منفی حول محور خودش میتواند یک میدان مغناطیسی را به وجود آورد. هر ترکیبی از ۴ عدد کوانتومی یک موقعیت انرژی معینی را برای الکترونهای موجود در مدارهای اتم ممکن میسازد. طبق نظریه پاولی (یا اصلطر پاولی) در یک اتک تنها یک الکترون میتواند یک موقعیت معینی را انرژی را دارا باشد و در یک اتم هیچ دو الکترونی یافت نمیشود که از نظر هر چهار عدد کوانتومی برابر باشد.
به عبارت دیگر اگر سه عدد موانتومی برای دو الکترون از اتکی با هم برابر باشند چهارمین عدد کوانتومی آنها یعنی Ms برای یک الکترون ۱/۲+ و برای دیگری ۱/۲- خواهد بود. اصل پاولی حداکثر تعداد الکترونهایی که میتواند در یک اوربیتال باشد را برای دو الکترون محدود میسازد.
هر گاه یک اوربیتال دارای دو الکترون یا به عبارت دیگر یک جفت الکترون باشد، به دلیل اینگه چهارمین عدد کوانتومی آنها ۱/۲+ و ۱/۲- است، وجود این جفت الکترون با اسپین مخالف (که معمولا با علامت ↑↓ نمایان میشود) سبب خواهد شد که اثر مغناطیسی الکترونها از بین برود، زیرا که میدان مغناطیسی دو الکترون در خلاف جهت یکدیگرند.
این اثر رادیامگنتیک مینامند. وقتی که در کی اتم اوربیتالی با یک تن الکترون اشغال شده باشد (↓). در این صورت در این اتم مغناطیسی این تک الکترون باقی میماند و میتواند مانند یک مغناطیس و چک عمل میکند، به طوری که میتواند جذب یک میدان مغناطیسی خارج شود. این پدیده را پارامگنتیک مینامند.
با توجه به مطالب گفته شده پایینترین موقعیت انرژی برای الکترون موقعیت ۱s است و به دنبال آن به ترتیب موقعیتهای ۲s,2p,3p,… در اینجا سلسله ردیف شکسته می شود& زیرا سلطوح یا موقعیتهایی با انرژی بالاتر وجود دارد که توسط الکترونهایی اشغال نشده است. برای مثال پس از پر شدن قشر ۳p قبل از ایکه موقعیت ۳d اشغال شود ابتدا اوربیتال ۴s پر و پس از آن ۳d ئر میشود. از طرفی در حالی که در موقعیت s هر یک از قشرهای ۱s.2s,3sو … با دو الکترون (Ms=±۱/۲ , ∂M=0 , ∂=۰) پر میشود. در موقعیت P هر یک از قشرهای ۲p,3p,4p , … با سس الکترون و در موقعیت d هر یک از قشرهای ۳d,4d,5d,… یا ده الکترون پر میشود. بدین ترتیب برای فلزی مانند منیزیم اشغال اوربیتالهای مختلف توسط الکترونها عبارتاند ۱s∧۲,۲s∧۲,۲p∧۶,۳s∧۲٫
برای انتقال الکترون از یک موقعیت با انرژی کمتر با انرژی کمتر به موقعیت دیگری با انرژی بیشتر یک انرژی کوانتومی معینی لازم است که مجددا و اغلب موقعی که الکترون به موقعیت اولیه بر میگردد. این انرژی به صورت اشعه آزاد خواهد شد. برای یک فاصله کاملا معین بین اتمها مقدار کل انرژی مجموعه اتمها به کمترین مقدار خود می رسد و این موقعیت، یک موقعیت پایداری است که در فاصله بین دو اتم همسایه در یک شبکه فضایی عامل کاملا تعیین کننده است.
در این فاصله فقط موقعیتهای الکترونهای خارجی ۳p,3s تحت تاثیر قرار خواهند گرفت و الکترونهایی که در سطح انرژی پایینتر قرار گرفته، ابتدا پس از نزدیک شدنهای بعدی دو اتم به هم خواهد خورد، آنچه که عملا فقط به ازای فشار بالاتر پدیدار میشود.


نظری یافت نشد.