کتاب اصول علم و مهندسی توسط قلم توانای استاد سید حسین تویسرکانی به تالیف درآمده؛ و در دسترس علاقه مندان قرار گرفته است. هر مبحث این کتاب شما را به دریچهای از دانش علم مواد میبرد. امروز بخشی از کتاب اصول علم مهنرسی و مواد با عنوان انواع پیوند اتمی در جامدات را با یکدیگر میخوانیم. در این بخش انواع پیوند اتمی در جامدات را بررسی میکنیم. مبحثی جذاب و بسیار زیبا را استیل پایدار به اشتراک میگذارد.
انواع پیوندهای اتمی در جامدات
انواع پیوند اتمی در جامدات: مواد جامد همگی از اتصال اتمهای یکسان و یا متفاوت تشکیل شدهاند. نیروهای بین اتمی یا به عبارتی پیوندهای اتمی مواد در اثر تاثیرات متقابل الکترونهای مدار خارجی بر یکدیگر است. این تاثیرات متقابل از انواع مختلف بوده و به آرایش الکترونی الکترونهای موجود در یک ماده و موقعیت آن ماده در سیستم تناوبی موجود بستگی خواهد داشت. این تاثیرات متقابل مختلف یا به عبارت دیگر پیوندهای اتمی متفاوت، خواص مکانیکی، فیزیکی و شیمیایی انرژی پتانسیل یونی را میتوان به کمک روابط داده شده محاسبه کرد. انرژی پتانسیل بین دو یون که در فاصله بینهایت از یکدیگر قرار گرفته، صفر فرض شده است، زیرا انرژی پتانسیل برابر حاصل ضرب نیرو در فاصله است. مینیمم انرژی پتانسیل در موقعی است که نزدیکترین فاصله بین مراکز دو یون برابر a0 است و این مینیمم انرژی پتانسیل نشاندهنده حالت تعادل پایدار بین دو یون است. همانطور که از رابطه انرژی پتانسیل یعنی

(q1,q2 بار الکتریکی دو یون و a فاصله بین مراکز دو یون) نتیجه میشود اگر بارهای الکتریکی یونهای مورد نظر هر دو مثبت یا هر دو منفی باشد این یونها یکدیگر را دفع میکنند و در نتیجه انرژی پتانسیل آنها افزایش مییابد و عمل نزدیک کردن این دو یون از فاصله بینهایت به فاصله a با دادن انرژی به سیستم امکانپذیر است و در صورتی که اگر بار الکتریکی یون مثبت و بار الکتریکی یون دیگر منفی باشد، عمل نزدیک شدن این دو یون از فاصله بینهایت به فاصله a با آزاد شدن انرژی همراه است، یعنی این دو یون یک دیگر را جذب میکنند و انرژی پتانسیل سیستم کاهش مییابد.
در مقایسه بافلزات، کریستالهای یونی دارای قابلیت هدایت الکتریکی بسیار ضعیف هستند. زیرا که در این نوع کریستالها جریان الکتریکی توسط حرکت ابر الکترونی توسط حرکت ابر الکترونی انجام نمیگیرد بلکه توسط حرکت یونها آن هم هنگامی که ماده تحت تاثیر پتانسیل الکتریکی بالا گیرد و یا موقعی که ماده به صورت الکترولیز درآید، یعنی در اثر جابهجایی یونها، انجام میگیرد.

برخلاف فلزات، کریستالهای یونی سخت و تردند و عملا قابلیت تغییر شکل پلاستیکی ندارند.
پیوندهای یونی بین عناصر چند ظرفیتی به علت انرژی پتانسیل بیشتر قویتر از پیوند یونی بین عناصر یک ظرفیتی است. به همین علت که اکسیدهای فلزات که سرامیکها را تشکیل میدهند دارای نقطه ذوب بسیار بالا که از مشخصات ویژه این گونه مواد است میباشند. قدرت پیوند یونی همچنین بر مدول الاستیکی و ضریب انبساط حرارتی تاثیر خواهد داشت.
پیوند کووالانسی یا اتصال اشتراکی
پیوند کووالانسی از به اشتراک گذاشتن الکترونهای قشر خارجی برای بدست آوردن وضعیت پایدار دو اتم حاصل میشود. سادهترین مثال برای این پیوند مولکول H2 است. در مولکول هیدروژن هر دو الکترون همزمان به هر دو هسته هیدروژن تعلق دارد یا به عبارتی هر دو الکترون اوربیتال ۱S احتمال اقامت در یک محل در اطراف هسته را بهطور همزمان داراست. در پیوند اشتراکی، جاذبه کولمبی وارد نمیشود. اتصال اشتراکی از نیروی جاذبه الکترونهایی که اغلب بین هسته مثبت دو اتم در حرکت است به وجود میآید. محاسبه این نیروها پیچیدهتر از محاسبه نیروها در ترکیبات یونی است.
مولکولهای موادی مانند O2, N2,F2,Cl2 که دارای پیوند کووالانسی هستند اهمیت چندانی به عنوان موارد مورد نظر ما ندارد. شرط اولیه برای اینکه یک جسم پایدار یا نقطه ذوب بالا به وجود آید این است که پیوند کووالانسی بین تعداد زیادی از اتمها به وجود آید که چنین چیزی در موارد ذکر شده موجود نیست. از طرفی مولکول گاز متان به صورت یک چهار وجبی منظم است که اتم کربن به وسیله چهار اتم هیدروژن در گوشههای آن احاطه و اتصال بین کربن و هیدروژن بیشتر به صورت کووالانسی است. ولی چون اتصالات در متان اشباع شده است بین مولکولها نیروهای قوی وجود ندارد و بدین جهت متان تا ۱۶۱- درجه سانتیگراد به حالت گاز است.
هرگاه به جای اتمهای هیدروژن در گوشههای چهاروجهی، اتمهای کربن را قرار دهیم، بدین ترتیب هر اتم کربن با هر اتم مجاور خودش دو الکترون به اشتراک میگذارد و از طرفی هر اتم کربن نقطه آغازی برای اتصال با چهار اتم کربن دیگر است به طوری که یک مولکول بسیار کوچک میتواند به وجود آید.
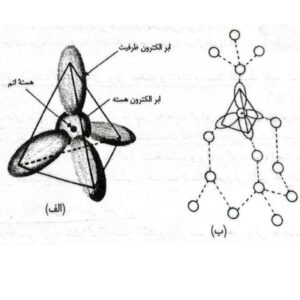
شکل بالا را مشاهده کنید. در این نوع پیوند آرایش اتمها به صورت متراکمترین شکل نخواهد بود بلکه با جهت اتصال کووالانسی مشخص میشود، بدین گونه که اوربیتالهای اتمهای مجاور برای به اشتراک گذاشتن الکترون خود در امتداد هم قرار میگیرد و در نتیجه پیوند حاصله جهتدار است و بنابراین برای تشکیل یک شبکه فضایی منظم جهت و فاصله هر اتم همسایه در کربن کاملا مشخص است.
شکل پایین که مشاهده میکنید ساختا رالماس نام دارد.

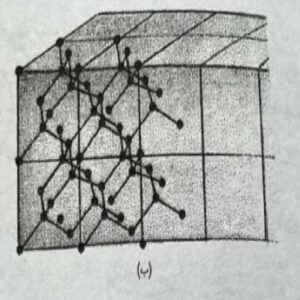
این گونه پیوند کووالانسی، اتمها را به صورت بسیار محکمی به یکدیگر اتصال میدهند و سبب سختی بسیار زیاد و نقطه ذوب بسیار بالای الماس (۳۸۰۰ درجه سانتیگراد) میشود. یک چنین ساختاری نه تنها در عناصر C,Si و Ge بلکه در ترکیباتی مانند Ga∧-۳As∧-۵ , IN∧-۳Sb∧-۵ , Zn∧-۲S∧-۶ , Cd∧-۲Te∧-۶ دیده میشود، این ترکیبات در ساخت نیمه هادیها نقش بسیار مهمی دارند. در حالی که ترکیبات SiO2 در مواد سرامیکی به واسطه وجود پیوندهای کووالانسی و یونی خواص ویژهای خواهد داشت.
همچنین خواص فیزیکی بسیاری از مواد پلیمری (شامل پلاستیکها و الاستومرهایی چون لاستیک) تا حدودی به پیوند کووالانسی موجود در بین اتمهای کربن با دیگر اتمها ارتباط دارد. پیوند کووالانسی پیوند بسیار قوی است. مواد با پیوند کوالانسی محض شکل پذیری ضعیف، هدایت الکتریکی و حرارتی بسیار کمی دارند.
البته لازم به تذکر است که شکل کربن بیشتر صورت گرافیت یافت شده و شکل معمولی آن الماس است. ساختار گرافیت بدون صورت است که هر سه اتم کربن با پیوند اشتراکی با زاویه ۱۲۰ درجه نسبت به یک دیر در یک صفحه قرار دارد. سه صفحه از این گونه صفحات در شکل زیر نشان داده شده است.
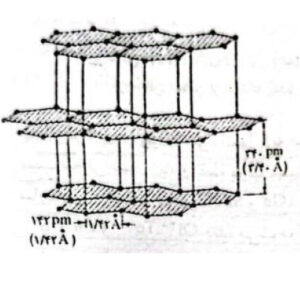
ساختار شش ضلعی بیانگر زاویه ۱۲۰ درجه بین اوربیتالهاست. کربن چهارم و در نتیجه لایههای اتمی توسط نیروهای ثانویه ضعیف که در قسمت پیوند واندروالس مورد مورد بحث قرار خواهد گرفت به یک یدگر اتصال مییابد. این ساحتار، ساختار گرافیتی نام دارد. به سبب همین پیوند ضعیف است که لغزش لایههای گرافیت بر روی یک دیگر انجام میگیرد. در نتیجه این ساختار است که گرافیت دارای قابلیت هدایت الکتریکی است در صورتیکه الماس هادی الکتریسیته نیست.
پیوندهای ثانویه
پیوندهای ثانویه یا پیوندهای واندروالسی پیوندهای بین گازهای ایدهآل (مانند نئون و آرگون و …) یا مولکولهای پایدار مانند متان و مواد آلی دیگر، در حالت مایع و جامد است. به همین دلیل پیوندهای ثانویه ربطی به الکترونهای ظریف ندارند و در نتیجه پیوندهای ضعیفی از نوع الکترواستاتیکی است. نیروی بین اتمی این پیوندهای ضعیف در اثر ارتعاشات حرارتی از بین خواهد رفت. پیوندهای واندروالس در درجه حرارتهای پایین ظاهر میشود. بدین جهت میتوان گازهای بیاثر را در درجه حرارتهای بسیار پایین به حالت مایع یا جامد در آورد. عدم استحکام این پیوندها را میتوان از پایین بودن نقطه ذوب و تبخیر گازهای بیاثر دریافت. این پیوندها هرچند ضعیف است ولی در مواردی که تنها عامل پیوند دهنده اتمها ومولکولها باشد اهمیت فراوانی خواهد داشت.
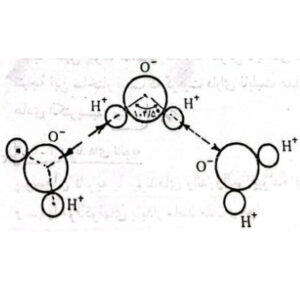
اصولاً مولکولها از لحاظ الکتریکی خنثی هستند. ولی اگر مراکز بارهای مثبت و منفی آنها بر یکدیگر منطبق نباشد میتواند دو قطبیهای دائمی باشد. این امر در مورد مولکول آب مشاهده میشود. در شکل پایین مولکول آب را مشاهده میکنید. الکترونها بیشتر وقت خود را در فضای بین اتمهای هیدروژن و اکسیژن میگذارنند، و در نتیجه اتمهای هیدروژن بار مثبت و اتمهای اکسیژن بار منفی پیدا میکنند.
اتمهای مثبت یک مولکول آب انتهای منفی مولکول دیگر آب را جذب کرده و پیوند تشیکل میشود. پیوندهای دو یون قطبی را که قطب مثبت هیدروژن باشد پیوندهای هیدروژنی مینامند که به سبب کوچکی یون هیدروژن میتواند نسبتا قوی باشد. بسیاری از مولکولهای دارای دو قطبیهای دائمی است و پیوندهای بین این مولکولها پیوندهای دو قطبی دائمی نام دارد. این این پیوندها جهت دار هستند.
پیوند دو قطبی به روش دیگری نیز میتواند ایجاد شود. اتم نئون را که در شکل (الف) زیرمشاهده می کنید به صورت کامل نشان داده است. در نظر بگیرید که الکترونها به صورت متقارن حول هسته اتم نمایش داده شده است.ولی در واقع نمیتوان انتظار داشت که در هر لحظه چنین تقارنی وجود داشته باشد. احتمال اینکه دفعتا الکترو» های بیشتری در یک طرف هسته جمع شود وجود دارد میتوانید شکل (ب) رامشاهده کنید.
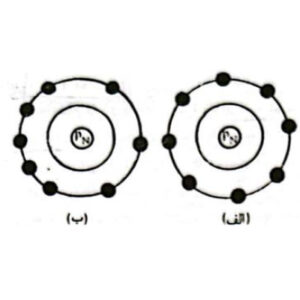
احتمال اینکه دفعتا الکترونهای بیشتری در یک طرف هسته جمع شود وجود دارد، شکل بالا (ب) را مشاهده کنید. با این آرایش دو قطبی که با زمان تغییر میکند در اتم ایجاد میشود. این دو قطبی متغیر روی دو قطبیهای متغیر اتمهای دیگر تاثیر میگذارد و در نتیجه یک نیروی جاذبه بین آنها به وجود میآید که نیروی جاذبه پراکنده نام دارد. این پدیده موجب ایجاد پیوندهای ضعیفی به نام پیوندهای واندروالسی میشود که جهت دار نیست.
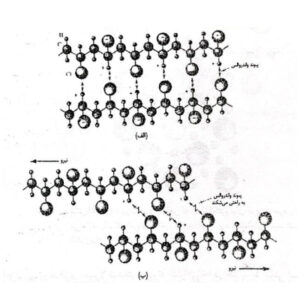
پلیمرها اغلب دارای پیوند کوالانسی بوده و از این رو بسیار ترد هستند، اما پلیمر پلیوینیل کلراید (پلاستیک PVC) به دلیل داشتن پیوند واندروالس بین زنجیرهای مولکولی در جهت خاصی شکل پذیر است.
شکل زیر را با دقت تماشا کنید.
پیوند فلزی
چنانچه از نام آن برداشت میشوداین نوع پیوند در فلزات و آلیاطهایی با الکترونگاتیویته پایین دیده میشود. پیوند فلزی بسیار شبیه پیوند کووالانسی است. در پیوندهای فلزی هر اتم الکترونهای قشر خارجی خود را (زمانی که اتمهای فلز برای ایجاد کریستال جامد به یکدیگر نزدیک میشود) آزاد میسازد. به عبارت دیگر میتوان گفت که این الکترونها همانند آن حالتی که در پیوند اشتراکی وجود داشت به اتمهای مجاورش تعلق نداشته بلکه به تمامی اتمهای موجود در کریستال تعلق دارد. همانطور که در شکل زیر مشاهده میکنید.
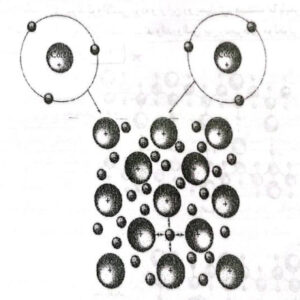
این الکترونها قشر خارجی که تمامی فضای بین بونهای اتمها را پر میکند “گاز الکترونی” نامیده میشود که به طور آزادانه و سریع بین یونها در حرکت است. اتصال بین یونهای مثبت با بار منفی گاز الکترونی به وجود میآید. حرکت آزادانه و سریع الکترونهای قشر خارجی یکی از دلایل عمده قابلیت هدایت الکتریکی است و همچنین حرارتی زیاد از فلزات و عدم شفافیت آنها در مقابل نور است.
پیوند فلزی معمولا ضعیفتر از پیوند اشتراکی اما در حد پیوند یونی است. پیوند فلزی برخلاف پیوند اشتراکی جهتدار نیست به این دلیل که تمایل فلزات برای ساخت تکههای فضایی با متراکمترین شکل زیاد است.
برای محاسبه تعداد الکترونهای الکتریسیته در یک سانتیمتر مکعب نقره این چنین عمل میکنیم.






نظری یافت نشد.