کتاب اصول علم و مهندسی توسط قلم توانای استاد سید حسین تویسرکانی به تالیف درآمده و در دسترس علاقه مندان قرار گرفته است. هر مبحث این کتاب شما را به دریچهای از دانش علم مواد میبرد.در هر بخش میتوانید دانشی را کسب کنید که در دنیای به این بزرگی شاید کم کسی باشد که این اطلاعات را در اختیار داشته باشد.امروز بخشی از کتاب اصول علم مهنرسی و مواد با عنوان ساختار اتم، جرم اتم و عدد اتمی مواد را با یکدیگر میخوانیم. در این بخش ساختار جرم عدد اتمی مواد را بررسی میکنیم. دنیایی متفاوت و بسیار زیبا را با استیل پایدار ببینید.
ساختار اتم
ساختار جرم عدد اتمی مواد
میدانیم که ماده از تعدادی اتم تشکیل شده است و هر اتم شامل هستهای است که توسط الکترونها احاطه شده است. قسمت عمده وزن اتم متعلق به هسته اتم است که از مجموع پروتونها و نوترونها تشکیل شده است. وزن هر پروتون، نوترون و الکترون در جدول زیر میباشد.
| هر پروتون | ۱٫۶۷۳*۱۰∧-۲۴ گرم |
| هر نوترون | ۱٫۶۷۵*۱۰∧-۲۴ گرم |
| هر الکترون | ۹٫۱۰۹*۱۰∧-۲۸ گرم |
هسته اتم بیشتر خواص اتمی ماده را مشخص میسازد که این خواص به آرایش اتمی و نوع پیوندهای اتمی آن بستگی زیادی نخواهد داست. از جمله این خواص میتوان از: تمام خواص فیزیکی هستهای مانند قابلیت جذب نوترون و شکافته شدن و همچنین چگالی اتم که ابتدا به وسیله نوع هسته اتم مشخص میشود، نام برد.
هسته اتم دارای بار مثبت است. در فضای اطراف الکترونها که دارای بار الکتریکی منفی است در حرکتاند.توزیع این الکترونها به دو رهسته را میتوان شبیه به ابر متحرکی در اطراف هسته فرض کرد. چگالی این ابر الکترونی معادل با احتمال پیدا کردن یک الکترون در محلی در اطراف هسته اتم است. تعداد الکترونها و پروتونها با هم برابراند. با توجه به اینکه قطر هسته اتم حدود ۱/۱۰۰۰ قطر اتم است، میتوان گفت که قسمت عمدهای از فضای اتم خالی است. بین هسته و الکترونها نیروی جاذبه الکترواستاتیکی قوی وجود دارد که آنها را به یک دیگر متصل میسازد.
عدد اتمی
تعداد پروتونهای موجود در هسته اتم را مشخص میکند. در هر اتم چون تعداد الکترونها و پروتونها با هم برابر است؛ ازاینرو از لحاظ بار الکتریکی خنثی است. هر عنصر عدد اتمی خاص خود را دارد.
در جدول تناوبی عناصر برحسب افزایش عدد اتمی خودتنظیم و به ترتیب در ردیفهای افقی قرار گرفتهاند. عدد اتمی مشخصکننده تغییرات یکنواخت در خواص شیمیایی و بیشتر خواص فیزیکی یک عنصر محسوب میشود. بسیاری از خواص عناصر تغییرات تناوبی دارد و عناصر با خواص مشابه در جدول تناوبی در ستونی عمودی به نام گروه قرار گرفتهاند. تمام عناصر یک گروه دارای تعداد الکترونهای قشر خارجی یا الکترونهای ظرفیت برابرند که منجر به داشتن خواص شیمیایی مشابه خواهد شد.
جرم اتمی
برای دسترسی بیشتر به منابع کتاب اصول علم مهندسی مواد فقط کافیست کلیک کنید و استیل پایدار را دنبال کنید.
جرم اتمی یک اتک جرم آن را نسبت به اتم های دیگر مشخص میکند. با توجه به اینکه پروتونها و نوترونها تقریبا تمام جرم اتم را تشکیل میدهند؛ جرم اتی به صورت تعداد کل یا تعدادمتوسط (در مورد ایزوتوپها) پروتونها + نوترونها تعریف میشود. برای مثال جرم اتمی کربن با ۶ پروتون و ۶ نوترون برابر ۱۲ واحد جرم اتمی است. اما به دلیل اینکه جرم یک اتم عدد کوچکی است در شیمی واحد بزرگتر از یک اتم را برای مقایسه مقدار گوناگون انتخاب کردهاند. این واحد گرم مل (gram – mole)یا به صورت سادهتر مل نامیده شده است. بنابراین برای مثال یک گرم مل یا یک مب از آلومینیوم ۲۶/۹۸ گرم جرم دارد و شامل تعداد ۲۳∧۱۰*۶٫۰۲۳ اتم است. به عبارت دیگر جرم یک مل از اتمها که شامل تعداد ۲۳∧۱۰*۶٫۰۲۳ است یک اتم گرم نامیده میشود. از این رو واحد وزن اتمی ۱-∧g.mol است.
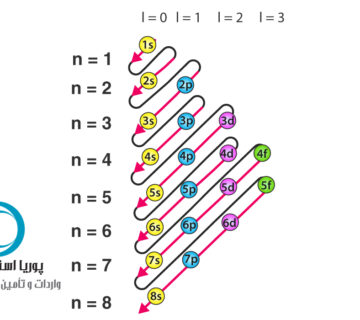
اغلب خواص مواد به رفتار الکترونها اطراف هسته اتم که تعداد آنها برابر تعدادپروتونهاست بستگی خواهد داشت. از بین این الکترونها، الکترونهای قشر خارجی یا الکترونهای ظریف نقش مهمی در تعیین خواص مواد دارد. این الکترونهای ظرفیت، خواص فیزیکی، مکانیکی و شیمیایی مواد را مشخص میسازد. بدین جهت مطالعه ساختار الکترونی اتم یا به عبارت دیگر آرایش الکترونی اتم در علم مواد اهمیت دارد.



سلام. بسیار مطلب عالی و کاربردی بود. ممنونم